Edaravone ist in Japan mit dem Namen Radicut und den USA unter dem Handelsnamen Radicava zur Behandlung der Amyotrophen Lateralsklerose (ALS) zugelassen. Trotz einer fehlenden Zulassung von Edaravone in Europa ist das Medikament als Einzelimport (gem. §73 Arzneimittelgesetz) auch in Deutschland verfügbar.
Studien mit Edaravone zeigen einen moderaten Effekt auf den Krankheitsverlauf der ALS. Eine Herausforderung in der Behandlung mit Edaravone besteht darin, daß dieses Medikament intravenös verabreicht wird und regelmäßige Infusionen erfordert.
Mit dem Ziel offene Fragen zur Versorgung von Edaravone bei der ALS zu beantworten, nehmen die führenden ALS-Zentren in Deutschland an einer Registerstudie zur Nutzererfahrung („user experience“) und Patientenzufriedenheit mit Edaravone teil. Im Zeitraum von Juli 2017 bis Januar 2018 wurden 30 ALS-Patienten aus dem Ambulanzpartner Netzwerk gewonnen, um an einer Online-Umfrage zu Edaravone teilzunehmen. Dabei wurde die NPS-Skala zur Patientenzufriedenheit erhoben.
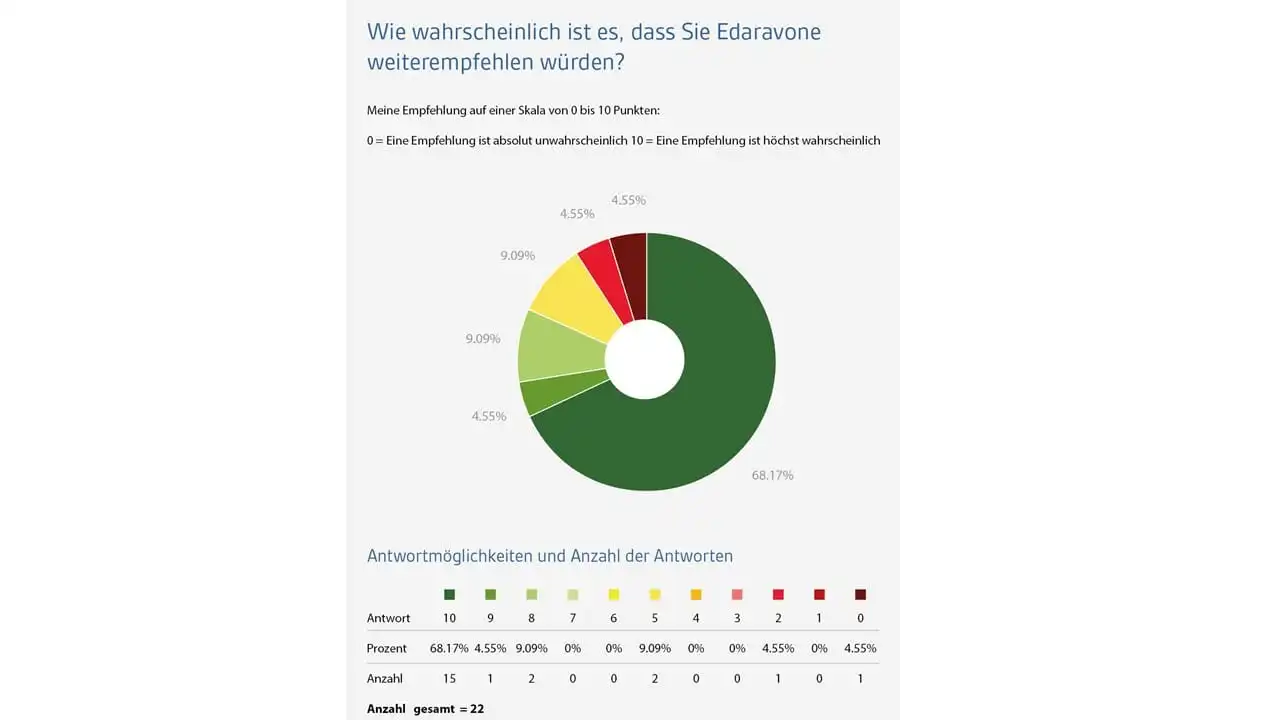
Mit dem Net Promotor Score (NPS) wird die Wahrscheinlichkeit der Weiterempfehlung von Edaravone durch die Formulierung der folgenden Frage erfasst: „Wie wahrscheinlich ist es, dass Sie Edaravone einem Freund (m/w) oder Kollegen (m/w), der an einer ALS erkrankt ist, weiterempfehlen würden?“ Die Antworten erfolgen auf einer Nominalskala zwischen 0 (absolut unwahrscheinliche Weiterempfehlung) und 10 (höchstwahrscheinliche Weiterempfehlung) Skala-Punkten. Eine erste Zwischenauswertung zeigt – trotz der komplexen Umstände der intravenösen Medikamentengabe – eine hohe Weiterempfehlungswahrscheinlichkeit von Edaravone. So gaben über 72% der Patienten eine wahrscheinliche Weiterempfehlung (10 oder 9 Punkte) von Edaravone an.
In der Ambulanzpartner Umfrage wurden auch Ergebnisse zur Behandungszufriedenheit (TSQM-9) und zum Krankheitsverlauf (ALS-Funktionsskala, ALS-FRS) erhoben. Die Daten zum ALS-FRS und TSQM-9 werden erstmals im Rahmen eines wissenschaftlichen Treffens auf der Jahrestagung der Deutschen Gesellschaft für Klinische Neurophysiologie und Funktionelle Bildgebung (DGKN) am 16. März 2018 in Berlin vorgestellt.
Diese Website verwendet Cookies, um Ihre Erfahrung zu verbessern. Wir gehen davon aus, dass Sie damit einverstanden sind, aber Sie können sich abmelden, wenn Sie möchten. Mehr erfahren
Im Falle des Verkaufs Ihrer persönlichen Informationen können Sie sich über den Link abmelden. Meine persönlichen Daten nicht verkaufen